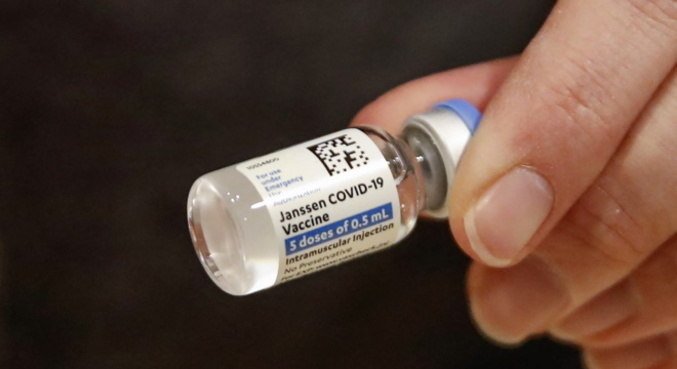
“Até que o processo seja concluído, recomendamos a pausa”, completou.
A agência reguladora informou que mais de 6,8 milhões de pessoas receberam a vacina da Johnson, nos Estados Unidos. O imunizante é o único que apresenta eficácia após aplicação de dose única.
“Os CDC e a FDA estão revisando dados de seis casos reportados nos Estados Unidos de um tipo de coágulo sanguíneo raro e severo produzido em indivíduos depois que receberam a vacina. Neste momento, estes eventos adversos parecem ser extremamente raros”, escreveu a FDA no Twitter.
A agência afirmou que pede a interrupção para permitir que os profissionais de saúde planejem “o tratamento único necessário para este tipo de coágulo sanguíneo”.
Todos os casos aconteceram em mulheres entre 18 e 48 anos, e os sintomas foram de seis a 13 dias após o recebimento da vacina. De acordo com comunicado do FDA, o tratamento deste tipo específico de coágulo sanguíneo é diferente do tratamento normalmente dado.
“O medicamento anticoagulante chamado heparina é geralmente usado para tratar coágulos sanguíneos. Nesse contexto, a administração da heparina pode ser perigosa e tratamentos alternativos precisam ser administrados”, recomendou a agência no comunicado à imprensa.
Os CDC reunirão um comitê consultivo na quarta-feira “para revisar mais a fundo os casos e avaliar sua importância potencial. A FDA revisará a análise, pois também investiga os casos”.
A declaração foi feita alguns dias depois do anúncio da Agência Europeia de Medicamentos (EMA) de que também está examinando possíveis casos de coágulos de sangue em pessoas que receberam o fármaco da Johnson.
No Brasil, o imunizante tem aprovação da Agência Nacional de Vigilância Sanitária (Anvisa) e o Ministério da Saúde comprou 38 milhões de doses. A previsão de entrega é no terceiro trimestre de 2021.
Fonte: R7